
Raccomandazioni, risultati numerici e nominali
Controllo interno di qualità, precisione (ripetibilità e riproducibilità) e incertezza di misura fanno parte della stessa famiglia, quella della “qualità degli esami”, il cui primo obiettivo è rassicurare gli operatori del laboratorio che tutto sta andando abbastanza bene. Poi viene il resto. Interpretare il significato dei risultati degli esami, confrontare metodi diversi e…chi più ne ha più ne metta! Paulo Pereira ha usato l’incertezza di misura per ridurre i falsi negativi, nello screening immuno-chimico per le malattie infettive dei donatori di sangue.
Su questi temi è disponibile una vasta letteratura, da cui però emergono problemi non ancora ben risolti, per cui è consigliabile prudenza. Per svolgere almeno il compito di rassicurazione in laboratorio, le procedure devono essere facilmente eseguibili, semplici, intuitivamente comprensibili, solide, non contestabili. La ISO 20914 ci mette sulla buona strada, una lunga lista di documenti ISO e CLSI fornisce strumenti solidi e convergenti per percorrerla ed arrivare alla meta. Strumenti che vanno conosciuti e le Raccomandazioni SIPMeL (documento Q16) vogliono aiutare a farlo.
Schema delle Raccomandazioni per l’incertezza di misura:
- il laboratorio dispone della stima dell’incertezza di misura per ciascun esame eseguito, di qualunque tipo;
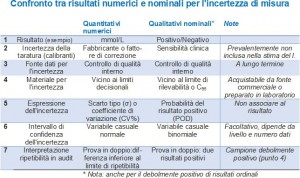
– il fabbricante dispone della componente di incertezza dovuta alla taratura dei calibranti, il laboratorio di quella dovuta a eventuali fattori di correzione;
– il laboratorio ricava la stima della componente precisione dai dati del controllo di qualità interno;
– il laboratorio rappresenta l’incertezza di misura con i parametri di dispersione della variabile casuale normale o standardizzata per i risultati quantitativi numerici, con la probabilità di un positivo per i risultati qualitativi nominali;
– il laboratorio calcola l’incertezza dai risultati di misure ripetute, sia per quelli numerici che per quelli nominali, su campioni vicini ai livelli decisionali o debolmente positivi;
– il laboratorio dispone dell’incertezza di misura per i risultati ricavati amplificazione degli acidi nucleici, sia numerici che nominali.
Di seguito alcune osservazioni sulla “famiglia della qualità degli esami“. Molti autori hanno studiato il comportamento dei risultati qualitativi, cercando di definire soprattutto le modalità per confrontare metodi diversi o per la validazione o la verifica. Si conoscono vari modi per stimare la precisione di un risultato qualitativo.
ISO 57251[1] . Trasforma i risultati di tipo binario (come presente/assente) nei valori 1 e 0, con cui si possono calcolare media e scarto tipo2. È facile vedere che in questo modo la media è la frequenza dei positivi, quindi la stima della precisione del risultato, mentre la dispersione della media, calcolata dalla varianza, è la stima della variabilità della precisione e diventa minore quanto più numerosi sono i replicati campionari. Dal punto di vista del laboratorio medico, solo la prima è utile. ISO 5725 non offre soluzioni per risultati ordinali, per i quali diventa necessario stimare la precisione separatamente.
ORDANOVA . E’ un metodo per indagare le differenze dei risultati di misurazione tra laboratori o tra metodi, quando i loro risultati consistono in dati categorici ordinali. Il calcolo parte ancora una volta dal conteggio dei risultati positivi, per ogni valore ordinale o categoria. Nei confronti si ottengono dalle frequenze le stime di ripetibilità, riproducibilità e varianza totale, arrivando così alla conclusione di uguaglianza (ipotesi zero) o differenza (ipotesi alternativa).
ISO 14468 – Utilizza per questo scopo nel metodo noto come “Attribute Agreement Analysis (AAA)”: una statistica k che parte dalla frequenza dei risultati positivi (Po). Possiamo notare come sia ORDANOVA che AAA vogliono analizzare il comportamento dell’intero gruppo di risultati ordinali, senza alcuna priorità. Nel laboratorio medico, tuttavia, il risultato “1+” non ha la stessa importanza e la stessa precisione del risultato “3+”. Ai fini pratici, investigare le caratteristiche prestazionali del risultato vicino al limite decisionale, solitamente “1+”, è adeguato alle necessità del laboratorio.
CU – Il “coefficiente di non somiglianza” (CU oppure u, unlikeability), proposto da Kader e Perry, però mai entrato nella pratica dei laboratori, è anch’esso un derivato diretto della frequenza dei risultati uguali, ponderata per il numero dei confronti. Un campione C95 avrebbe così un CU pari al 5% con 40 risultati (ovvero 20 confronti). Sarà del 10.5% con 20 risultati e 2.4% con 80. In questo modo, il coefficiente proposto potrebbe essere utile più per confrontare due metodi o un valore atteso, con numerosità fissa, piuttosto che per stimare la ripetibilità o la riproducibilità dei risultati con il metodo in uso.
Il controllo di qualità interno (IQC) è strettamente connesso all’incertezza ed alla sua componente di precisione: consente di individuare sia la dispersione dei risultati quantitativi numerici, sia la frequenza dei positivi per i risultati qualitativi nominali. La componente della precisione viene espressa come scarto tipo (σ) o coefficiente di variazione (CV%) per risultati quantitativi numerici e probabilità del positivo (POD%), per i risultati qualitativi nominali.
La precisione del risultato qualitativo è dunque misurata dalla frequenza dei positivi. C’è chi ha proposto i concetti di “accordanza” e “concordanza”, in perfetta analogia con “ripetibilità” e “riproducibilità”. Ma anche “affidabilità” (complemento a 100 di falsi positivi e falsi negativi), come parallelo dell’incertezza di misura.
Secondo Von Collani, la gestione inappropriata dell’incertezza nella scienza ha prodotto una varietà di “teorie dell’incertezza” che provoca confusione e sconcerto. La scienza moderna, così come si è sviluppata negli ultimi 500 anni, mira a scoprire la verità. La verità non ammette incertezza in quanto è rappresentata da un fatto. Di conseguenza, nella scienza, non c’è bisogno di sviluppare modelli e metodi per affrontare adeguatamente l’aspetto reale dell’incertezza.
In verità, l’incertezza è diventata un campo di gioco dei matematici. Quando però è calata nella realtà, vengono in primo piano le specificità delle singole professioni e discipline, in grado di cogliere nelle trattazioni teoriche ciò che serve agli obiettivi clinici.
Sostiene P. Pereira che per un risultato qualitativo, sia nominale che ordinale, al termine “incertezza di misura” si debba sostituire il termine “incertezza di condizione” (“condition uncertainty”), per l’intervallo di confidenza al 95% della sensibilità o specificità clinica. La teoria, finemente elaborata e presentata in numerose pubblicazioni, è formalmente ineccepibile. Tuttavia, richiede l’analisi del comportamento di campioni a diversi livelli, per elaborare una curva caratteristica operativa (ROC) e la sua area sottostante. Inoltre, è una teoria molto utile per interpretare i risultati, dove messa in atto, ma lascia scoperto l’aspetto tecnico esecutivo dell’esame di laboratorio.
La precisione del risultato qualitativo è dunque già misurata dalla frequenza dei positivi. L’inconveniente è che questa stima vale solo per il livello del campione studiato, ad esempio un C50 o un C95, non per altri livelli. Certamente questa stima ha una sua distribuzione statistica e quindi varianza, scarto-tipo e intervallo di confidenza. Anche i parametri dei risultati quantitativi (varianza, scarto-tipo e coefficiente di variazione) hanno una distribuzione statistica e intervalli di confidenza, che però, dal punto di vista pratico, incidono poco in laboratorio. La distribuzione statistica dipende dalla media e dal numero dei replicati, qualunque sia il tipo di risultato dell’esame.
La Raccomandazione SIPMeL è semplice, alla portata di tutti i laboratori, corrispondente perfettamente ad altre indicazioni di fonte autorevole: consiste nel ripetere almeno un campione “debolmente positivo” e conteggiare la percentuale di risultati positivi.
BIBLIOWEB:
SIPMeL Q16 – Raccomandazioni per la stima dell’incertezza di misura nei laboratori medici (ISO 15189 e ISO 20914) https://www.sipmel.it/it/lineeguida/sviluppo/118096
Neda Milinković, Snežana Jovičić & Svetlana Ignjatović (2021). Measurement uncertainty as a universal concept: can it be universally applicable in routine laboratory practice? Critical Reviews in Clinical Laboratory Sciences, 58:2, 101-112 DOI:10.1080/10408363.2020.1784838
Rigo-Bonnin, Raúl, Canalias, Francesca, El Haj, et al. “Measurement uncertainty of β-lactam antibiotics results: estimation and clinical impact on therapeutic drug monitoring” Clinical Chemistry and Laboratory Medicine (CCLM), vol. 58, no. 2, 2020, pp. 240-250. https://doi.org/10.1515/cclm-2019-0621
Bozkurt Yavuz, Hatice Karahan, Süleyman Caner,et al. “Two approaches for measurement uncertainty estimation: which role for bias? Complete blood count experience: “Turkish Journal of Biochemistry” – 2021- pp. 000010151520200357 https://doi.org/10.1515/tjb-2020-0357
Pereira, P., Magnusson, B., Theodorsson, E. et al. Measurement uncertainty as a tool for evaluating the ‘grey zone’ to reduce the false negatives in immunochemical screening of blood donors for infectious diseases. Accred Qual Assur 21, 25–32 (2016). https://doi.org/10.1007/s00769-015-1180-x
Van Schrojenstein Lantman, Marith and Thelen, Marc H. M. “The impact of measurement uncertainty on the uncertainty of ordinal medical scores based on continuous quantitative laboratory results” – Clinical Chemistry and Laboratory Medicine (CCLM), vol. 59, no. 8, 2021, pp. e309-e312. https://doi.org/10.1515/cclm-2020-1890
Westgard S. APS for MU: The New Era of allowable measurement uncertainty (MUA? AMU? AU?) https://www.westgard.com/mu-performance-specifications.htm
Federica Braga and Mauro Panteghini. Performance specifications for measurement uncertainty of common biochemical measurands according to Milan models, CCLM 2021; 59(8):1362-1368.
ISO 5725–2:1994. Accuracy (trueness and precision) of measurement methods and results – Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method. Geneva, Switzerland: International Organization for Standardization; 1994.
Suzuki T., Takeshita J., Ogawa M., et al. 2021. Analysis of Measurement Precision Experiment with Ordinal Categorical Variables. In: Knoth S., Schmid W. (eds) Frontiers in Statistical Quality Control 13. ISQC 2019. Frontiers in Statistical Quality Control. Springer, Cham.
Bashkansky, E., Gadrich, T. & Kuselman, I. Interlaboratory (2012) ISO/TR 14468:2010. Selected illustrations of attribute agreement analysis. Geneva, Switzerland: International Organization for Standardization, 2010.
Perry M, Kader G. Variation as unalikeability, Teach. Stat. 2005; 27:58–60.
Kader G, Perry M. Variability for categorical variables, J. Stat. Ed. 2007; 15:1–16.
Wehling P, LaBudde RA, Brunelle SL, et al. Probability of detection (POD) as a statistical model for the validation of qualitative methods. J AOAC Int 2011; 94:335–347
AOAC – International Guidelines for Validation of Qualitative Binary Chemistry Methods, Journal of AOAC Int 2014; 97:1492–1495.
Langton, S.D., Chevennement, R., Nagelkerke, N., et al. Analysing collaborative trials for qualitative microbiological methods: accordance and concordance. International Journal of Food Microbiology 2002:79:171 – 181.
Van der Voet H, van Raamsdonk LW. Estimation of accordance and concordance in inter-laboratory trials of analytical methods with qualitative results. Int J Food Microbiol. 2004 Sep 1;95(2):231-4.
Cárdenas S, Valcárcel M. Analytical features in qualitative analysis. TrAC Trends in Analytical Chemistry, 2005;24: 477-487.
Aguilera E, Lucena R, Cárdenas S, et al. Robustness in qualitative analysis: a practical approach. TrAC Trends in Analytical Chemistry, 2006;25:621-627,
Von Collani E. Uncertainty and Quality Control. In H.-I. Lenz et at. (eds.). Frontiers in Statistical Quality Control 10, Xth International Workshop on “Intelligent Statistical Quality Control”. 2012; 401-416.
Pereira P. Quality Control of Qualitative Tests for Medical Laboratories. Lisboa; 2020.
Pereira P, Westgard J, Encarnação P, et al. Evaluation of the measurement uncertainty in screening immunoassays in blood establishments: Computation of diagnostic accuracy models. Transfus Apher Sci 2015; 52:35-41.
Pereira P, Westgard J, Encarnação P, et al. Scheme for the selection of measurement uncertainty models in blood establishments’ screening immunoassays. Transfus Apher Sci 2015; 52:42‐47.
Paulo Pereira P, Sandra Xavier S. “p18 evaluation of the condition uncertainty of qualitative binary results as a measurement uncertainty analogy”. 12th National Scientific Congress SPML, 29–31 October 2020, Portugal. Clin Chem Lab Med 2021; 59:eA1–eA51.
Pereira P and Xavier S. Computation of the Diagnostic Uncertainty as an Alternative to the Determination of Measurement Uncertainty for HIV Qualitative Binary Results. M J HIV. 2018; 3: 019-025.
Kortenbusch M, Berger S, Rabenau HF. Validierung / Verifizierung von Methoden in der Virologie. 2017. Disponibile alla pagina: https://www.g-f-v.org/sites/default/files/Muster%20Verfahrensanweisung%20Validierung%202017.pdf [citato 31 agosto 2021]
ISO/TR 14468:2010. Selected illustrations of attribute agreement analysis. Confirmed in 2017. Geneva, Switzerland: International Organization for Standardization; 2010.
Rabenau HF, Kessler HH, Kortenbusch M, et al. Verification and validation of diagnostic laboratory tests in clinical virology. J Clin Virol. 2007; 40:93-8.
![]() Raccomandazioni per la stima dell’incertezza di misura nei laboratori medici (ISO 15189 e ISO 20914) – Agosto 2021 (PDF)
Raccomandazioni per la stima dell’incertezza di misura nei laboratori medici (ISO 15189 e ISO 20914) – Agosto 2021 (PDF)

Articoli correlati:
OTT













 Per qualsiasi comunicazione tecnica riguardante il presente Sito Web, potete contattare il WEBMASTER inviando un messaggio di posta elettronica. Grazie.
Per qualsiasi comunicazione tecnica riguardante il presente Sito Web, potete contattare il WEBMASTER inviando un messaggio di posta elettronica. Grazie.
About the Author
sito web e modulo per contatto: www.labmedico.it